Sản phẩm
Toluen 108-88-3
Giá liên hệ
Giới thiệu Toluene (công thức phân tử: C7H8) là một chất tương tự của benzen, còn được gọi là "methylbenzen" và "phenylmethane". Nó là một chất lỏng không màu, dễ bay hơi, có mùi đặc biệt. Toluene là một thành viên của họ hydrocarbon thơm. Trong không khí, toluene chỉ có thể cháy không hoàn toàn và ngọn lửa có màu vàng.
| giới thiệu | Toluene (công thức phân tử: C7H8) là một chất tương tự của benzen, còn được gọi là "methylbenzen" và "phenylmethane". Nó là một chất lỏng không màu, dễ bay hơi, có mùi đặc biệt. Toluene là một thành viên của họ hydrocarbon thơm. Trong không khí, toluene chỉ có thể cháy không hoàn toàn và ngọn lửa có màu vàng. Nhiều đặc tính của nó tương tự như benzen và có mùi thơm tương tự benzen. Trên thực tế, chúng thường được sử dụng làm dung môi hữu cơ để thay thế benzen độc hại. Toluene dễ dàng được clo hóa để tạo ra benzen chloromethane hoặc benzen chloroform, cả hai đều là dung môi công nghiệp tốt; brom có thể được tách ra khỏi nước brom, nhưng không thể phản ứng với nước brom; nó cũng dễ dàng nitrat hóa để tạo ra nitrotoluene hoặc O-nitrotoluene, cả hai đều là nguyên liệu thuốc nhuộm; một phần toluene và ba phần axit nitric được nitrat hóa thành trinitrotoluene (tên thường gọi TNT); nó cũng dễ dàng được sulfon hóa để tạo ra axit o-toluenesulfonic hoặc axit p-toluenesulfonic, là thành phần quan trọng trong sản xuất thuốc nhuộm Hoặc nguyên liệu để sản xuất saccharin. Hơi toluen trộn với không khí tạo thành chất nổ tạo ra TNT. |
| sử dụng | Toluene là thành phần của xăng, sơn, mực, vecni, chất pha loãng sơn, chất kết dính, sơn móng tay, chất tẩy rửa và cao su. BTX (hỗn hợp benzen, toluene và xylene) được thêm vào xăng để tăng chỉ số octan. Toluene được sử dụng trong sản xuất benzen, trinitrotoluene (TNT), nylon, nhựa và polyurethane. Nó cũng được sử dụng trong sản xuất ma túy lạm dụng. Toluene là chất được những người lạm dụng dung môi yêu thích, những người cố tình hít phải nồng độ cao để đạt được hiệu ứng hưng phấn. Nó được sử dụng trong sản xuất dược phẩm, thuốc nhuộm và các sản phẩm làm móng. Nó được sử dụng để chống giun tròn và giun móc. Bản tóm tắt ứng dụng chi tiết như sau: ngành công nghiệp
Trường ứng dụng
Vai trò/Lợi ích
sản xuất hóa chất
Sản xuất benzen và xylene
thành phần chính
Sản xuất axit benzoic
Sản phẩm oxy hóa của toluen
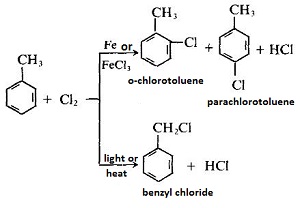
Sản xuất benzen clorua hoặc benzen chloroform
Sản phẩm clo hóa Toluene
Sản xuất p-nitrotoluene hoặc o-nitrotoluene
Sản phẩm nitrat hóa Toluen
Sản xuất axit o-toluenesulfonic hoặc axit p-toluenesulfonic
Sản phẩm sulfo hóa Toluene
xăng
xăng có chỉ số octan cao
Dùng làm chất tăng chỉ số octan để tăng chỉ số octan của xăng
sản xuất chất kết dính
dung môi thảm
Độ hòa tan tốt cho chất kết dính
Phân tích hóa học
ICP-AES, AAS, AFS, ICP-MS và sắc ký ion
Vật liệu đứng
Phân tích chuẩn độ
giải pháp thường trực
thư mục
chiết xuất huyết sắc tố
Giúp phá vỡ hoặc phá vỡ các tế bào hồng cầu
Mỹ phẩm và Chăm sóc cá nhân
Sản phẩm làm móng
Thêm vào để giúp làm bay hơi dung môi
người khác
Sơn, vecni, vecni, chất kết dính, nitrocellulose và mực
Dung môi và chất pha loãng
Sản xuất saccharin, thuốc nhuộm, thuốc, chất nổ...
nguyên liệu thô
|
| Sản xuất | Phần benzen thô của than cốc chứa 15-20% toluene, là nguồn toluene chính, mỗi tấn than cốc có thể tạo ra 1,1-1,3kg toluene. Kể từ những năm 1950, nguồn toluene chính của thế giới đã chuyển từ sản phẩm phụ luyện cốc sang Reforming xúc tác và Cracking hydrocarbon. Năm 1982, toluene dầu mỏ chiếm hơn 96% tổng sản lượng. Reformate xúc tác chứa 50-60% chất thơm (theo thể tích), trong đó hàm lượng toluen có thể đạt tới 40-45%; xăng nhiệt phân chứa khoảng 70% chất thơm (theo khối lượng), trong đó 15-20% là toluene. |
| sự phản ứng lại |
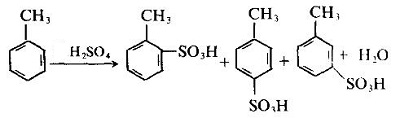
phản xạ nhiệt độ
Axit o-toluenesulfonic axit
axit axetat-p-toluenesulfonic
m-toluen axosulfonat
ở 0°C(%)
43
53
4
ở 100°C(%)
13
79
số 8
|
| Mối nguy hiểm và ảnh hưởng sức khỏe | 体内代谢 吸收到体内的甲苯80%在NADP(转缀酶II)存在下氧化为苯甲醇,在NAD(转缀酶I)存在下氧化为苯甲醛,然后氧化为氧气,转化为苯甲酸。 然后在三磷酸腺苷存在下与甘氨酸结合形成马尿酸。 因此,吸收到体内的甲苯16%-20%会通过呼吸道排出体外,80%以马尿酸的形式由肾脏排出。 人类健康影响 人们最有可能通过吸烟或使用含有甲苯的消费品(油漆、清漆、指甲油、脱漆剂、去污剂等)而接触到甲苯,特别是在没有良好的通风系统的情况下。 接触 100 ppm (377 mg/m3) 的甲苯后 6.5 小时出现眼睛和上呼吸道刺激,500 mg/m3 时观察到流泪。 连续四天每天接触 100 ppm(377 mg/m3)甲苯 6 小时的志愿者出现了头痛、头晕和醉酒的主观主诉。 在暴露于 750 mg/m3 剂量超过 8 小时的受试者中,观察到疲劳、肌肉无力、意识模糊、协调性受损、瞳孔放大和调节障碍; 当浓度约为 3000 mg/m3 时,会出现严重疲劳、明显恶心、精神错乱以及步态和瞳孔对光反射明显不协调。 高浓度接触后,肌肉疲劳、紧张和失眠会持续数天。 严重的意外暴露会导致昏迷。 没有足够的证据表明甲苯对人类具有致癌性。 有证据表明甲苯不会导致实验动物患癌症。 因此,甲苯不属于对人类有潜在致癌作用的物质。 |
| 描述 | 甲苯是一种透明、无色液体,具有类似苯的甜味。 甲苯天然存在于原油和甲苯工厂中。 它也在从原油生产汽油和其他燃料以及从煤炭生产焦炭的过程中产生。 甲苯用于制造油漆、油漆稀释剂、指甲油、清漆、粘合剂和橡胶以及一些印刷和鞣制工艺。 甲苯还用于生产用于制造尼龙、塑料汽水瓶、聚氨酯和药品、染料、美甲产品的聚合物以及有机化学品的合成。 据报道,甲苯是最常被滥用的烃溶剂,主要是通过“胶体嗅探”。 常见的高浓度甲苯暴露包括使用家用产品(例如油漆、油漆稀释剂、粘合剂、合成香料和许多其他来源)产生的室内空气。 |
| 化学性质 | C6H5CH3 也称为甲基苯或苯基甲烷,是一种无色、易燃、有毒液体。 不溶于水,溶于乙醇和乙醚,用于炸药、高辛烷值汽油和有机合成。 |
| 化学性质 | 甲苯是一种透明、无色、易燃液体,具有甜味/刺激性气味。 它广泛用作各种行业的溶剂,例如橡胶化学品、药品和药品的生产、油墨稀释剂、油漆染料和香水生产。 它是原油的天然成分,由炼油和焦炉作业生产。 甲苯作为原油的一种成分天然存在,并存在于炼油和焦炉操作中。 从事多种活动的职业工人,如染料、印刷油墨制造商、汽车油漆机械制造商、石油制造商、运输商和零售商、制造商和润滑油粘合剂和涂料工人、音响设备产品工人、化学工业工人、焦炉工人、织物制造商(织物涂料), |
| 化学性质 | 甲苯是一种透明、无色、无腐蚀性液体,具有类似苯的甜味、刺激性气味。 空气中的气味阈值分别为 0.17 ppm、2.9 ppm(新泽西州)和 8 ppm(EPA)。 水中气味阈值为0.04-1.0 mg/L |
| 物理特性 | 无色透明易燃液体,具有类似于苯的令人愉快的甜味或油漆气味。 40°C 时,可检测到的最低气味浓度为 960 μg/L。 同样,在 25°C 时,检测到气味的最低浓度为 960 μg/L(Young 等,1996)。 气味检测和识别的阈值浓度经实验确定分别为 600 μg/m 3 (160 ppb v ) 和 7.0 mg/m 3 (1.9 ppm v ) (Hellman 和 Small, 1974)。 莱昂纳多等人。 (1969) 报道了来自焦炭 (4.68 ppmv) 和石油 (2.14 ppmv) 的甲苯的气味阈值浓度较高 。)。 在 60°C 的水中和 40°C 的空气中检测到最少的平均气味阈值浓度分别为 24 和 140 μg/L(Alexander 等,1982)。 使用三角气味袋法测定气味阈值浓度为 330 ppbv(Nagata 和 Takeuchi,1990 )。Cometto-Muiz 和 Cain (1994) 报告的平均阈值浓度为 29,574 ppm v。 |
| 历史 | 甲苯是一种透明、易燃的芳香烃液体,具有与苯类似的气味。 又称甲苯,表明苯的一个碳原子上加有一个甲基。 1837 年,皮埃尔-约瑟夫·佩尔蒂埃 (Pierre-Joseph Pelletier,1788-1842) 和菲利普·沃尔特 (Philippe Walter,1810-1847) 首次分离出甲苯。甲苯这个名称来自南美的 Toluifera balsamum 树。 Henri-Etienne Sainte-Claire Deville (1818-1881) 于 1841 年从托鲁香脂树的汁液中分离出甲苯。甲苯 的主要来源是石油加工过程中石脑油的催化重整。 在此过程中,环烷烃脱水,形成芳烃,例如甲苯和二甲苯以及氢气。 甲苯也可以通过汽油的热解获得。 它是苯乙烯生产的副产品,也可以用煤焦油生产,而煤焦油是 20 世纪上半叶苯乙烯的主要来源。 |
| 用途 | 甲苯源自煤焦油和石油。 它存在于汽油和许多石油溶剂中。 甲苯用于生产三硝基甲苯(TNT)、甲苯二异氰酸酯和苯; 作为染料、药物和洗涤剂的成分; 以及作为橡胶、油漆、涂料和油类的工业溶剂。 |
| 用途 | 甲苯在化学和石油工业中有多种用途,美国每年使用约 600 万吨,全球使用量为 1600 万吨。 甲苯的主要用途是提高汽油的辛烷值。 甲苯的辛烷值为 114。甲苯是四种主要芳香族化合物之一,与苯、二甲苯和乙苯并列,是在精炼过程中产生的,用于改善汽油的性能。 这四种化合物统称为 BTEX。 BTEX 是汽油的主要成分,约占典型汽油混合物重量的 18%。 尽管芳香族化合物的比例不同,可以产生不同的混合物,以满足地理和季节的要求,但甲苯是主要成分之一。 典型的汽油含有约5%重量的甲苯。 甲苯是生产各种有机化合物的主要原料。 它用于生产二异氰酸酯。 异氰酸酯含有官能团?N=C=O,二异氰酸酯含有这两个官能团。 两种主要的二异氰酸酯是甲苯2,4-二异氰酸酯和甲苯2,6-二异氰酸酯。 北美二异氰酸酯的年产量达到近10亿磅。 甲苯二异氰酸酯产量的90%以上用于生产聚氨酯泡沫。 后者用作家具、床和床垫的柔性填充物。其硬质形态可用于绝缘材料、硬壳涂料、建筑材料、汽车零部件和滚轴溜冰轮。 |
| 用途 | 用于生产苯甲酸、苯甲醛、炸药、染料和许多其他有机化合物; 作为油漆、清漆、橡皮、塑料的溶剂; 油墨、香水、染料的稀释剂; 从植物中提取各种原理; 作为汽油添加剂。 |
| 定义 | ChEBI:甲苯类中最简单的成员,由带有单个甲基取代基的苯核心组成。 |
| 生产方法 | 苯是通过称为加氢脱烷基化的过程由甲苯生产的。 在此过程中,甲苯与氢气在铬、铂或钼催化剂存在下,在数百摄氏度的温度和约50个大气压的压力下发生反应:C6H5CH3+H2→C6H6+CH4。 甲苯还可用于生产苯酚(C6H5OH)、苯甲酸(C6H5COOH)和苯甲醛(C6H5CHO)。 甲苯的硝化形式会产生爆炸性化合物; 其中最常见的是 TNT(参见三硝基甲苯)。 |
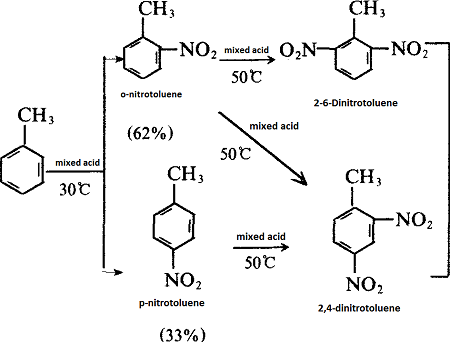
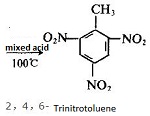
| 准备 | 甲苯是生产甲苯二异氰酸酯(TDI)的起始原料,可以通过不同的工艺生产不同异构体含量的产品。 甲苯的硝化(在30-45℃下用含有20%硝酸、60%硫酸和20%水的硝化混合物)得到2-硝基甲苯(约60%)和4-硝基甲苯(40%)的混合物)。 如果将该混合物进一步硝化(在65-80℃下用35%硝酸和65%硫酸的混合物)而不分离,产物是2,4-二硝基甲苯(约80%)和2,6的混合物- 二硝基甲苯(20%)。 另一方面,如果将混合的单硝酸盐分离(通过蒸馏),则随后的 2-硝基甲苯硝化将产生 2,4-二硝基甲苯(约 65%)和 2,6-二硝基甲苯(35%)的混合物,而随后的4-硝基甲苯硝化仅产生2,4-二硝基甲苯。 |
| 一般参考。 | 加拿大化学杂志,55,p。 3755, 1977 DOI: 10.1139/v77-529 化学快报, 11, p. 3755, 1977 DOI: 10.1139/v77-529 1707, 1982 四面体,17,页。 2689, 1976 |
| 一般说明 | 无色透明液体,具有特有气味。 闪点 40°F。 密度低于水(7.2 磅/加仑)且不溶于水。 从而浮在水面上。 蒸气比空气重。 吸入、摄入或皮肤接触可能有毒。 用于航空和汽车燃料、溶剂以及其他化学品的制造。 |
| 空气与水反应 | 非常易燃。 不溶于水。 |
| 反应概况 | 即使在-70°C,在二氯化乙基铝或倍半氯化乙基铝存在下,甲苯也会与烯丙基氯或其他烷基卤剧烈反应。 爆炸报告 [NFPA 491M 1991]。 与强氧化剂不相容。 当向罐中添加二氯化硫时,罐超压并在被认为由铁或氯化铁(III)催化的反应中破裂。 哥哥。 新闻,1988,66(32),2]。 |
| 危险 | 有易燃、火灾和爆炸危险。 空气中爆炸极限 1.27–7%。 通过食入、吸入和皮肤吸收有毒。 视力受损,影响女性生育能力和流产。 疑似致癌物。 |
| 不良 | 蒸气刺激眼睛和上呼吸道; 引起头晕、头痛、麻醉、呼吸停止。 该液体会刺激眼睛并导致皮肤干燥。 如果吸入,会引起咳嗽、呕吐、不适和快速肺水肿。 如果摄入,会引起呕吐、抽搐、腹泻、呼吸衰竭。 |
| 不良 | 甲苯的急性毒性较低。 甲苯可能会刺激眼睛、皮肤和呼吸道。 短期接触高浓度甲苯(如600 ppm)会导致疲劳、头晕、头痛、失去协调性、恶心和头晕; 10,000 ppm 会导致呼吸衰竭死亡。 摄入甲苯可能会导致恶心、呕吐和中枢神经系统抑制。 液体甲苯接触眼睛会引起暂时的刺激。 甲苯对皮肤有刺激性,当被困在衣服或鞋子下时会导致发红和疼痛; 长期或反复接触甲苯会导致皮肤干燥和开裂。 由于其气味和刺激作用,甲苯被认为具有良好的警示特性。 接触甲苯的慢性影响比接触苯的慢性影响要轻得多。 动物研究中尚未报告有致癌作用。 旨在确定动物发育影响的研究获得了不确定的结果。 在标准研究中未观察到甲苯具有致突变性。 |
| 不良 | 接触甲苯会对动物和人类的健康产生不利影响。 中毒和中毒症状包括但不限于轻度皮肤刺激、头痛、恶心和中枢神经系统影响。 长时间接触高浓度甲苯会导致视力障碍、头晕、恶心、中枢神经系统抑制、感觉异常和突然虚脱。 据报道,实验室大鼠急性口服甲苯 LD50 值为 636-7300 mg/kg。 据报道,接触甲苯会导致快速而严重的角膜损伤和结膜炎。 家兔急性经皮 LD50 为 1200 至 1400 mg/kg。 |
| 不良 | 甲苯的急性毒性与苯相似。 接触途径有吸入、食入和皮肤吸收; 受其暴露影响的器官是中枢神经系统、肝脏、肾脏和皮肤。 高浓度时它是一种麻醉剂。 对于人类来说,急性接触可能会导致欣快感、欣快感、幻觉、认知扭曲、混乱、头痛和头晕。 当空气中的暴露水平达到 200 ppm 时,就可以看到这种效应。较高浓度可能会导致抑郁、嗜睡和昏迷。 吸入 10,000 ppm 会导致人类因呼吸衰竭而死亡。 甲苯转化为苯甲酸,最后转化为马尿酸和苯甲酰葡萄糖醛酸。后两种物质与少量甲酚一起从尿液中排出,甲酚是由甲苯直接羟基化形成的。 长期接触会导致甲苯在脂肪组织中积聚,随着时间的推移可以消除。 甲苯的慢性影响比苯的慢性影响要轻得多。它不会导致骨髓衰竭或贫血。 动物试验显示无致癌作用。 |
| 火灾危险 | 甲苯是一种易燃液体(NFPA 等级 = 3),其蒸气可以传播很长的距离到达点火源并“适得其反”。 浓度为 1.4 至 6.7%(按体积计)的甲苯蒸气与空气形成爆炸性混合物。 火灾中产生的危险气体包括一氧化碳和二氧化碳。 扑灭甲苯火灾应使用二氧化碳和干粉灭火器。 |
| 火灾危险 | 火灾行为:蒸气比空气重,可以传播很长的距离到达火源并再次点燃。 |
| 易燃易爆 | 甲苯是一种易燃液体(NFPA 等级 = 3),其蒸气可以传播很长的距离到达点火源并“适得其反”。 浓度为 1.4 至 6.7%(按体积计)的甲苯蒸气与空气形成爆炸性混合物。 火灾中产生的危险气体包括一氧化碳和二氧化碳。 扑灭甲苯火灾应使用二氧化碳和干粉灭火器。 |
| 化学反应 | 与水反应 不反应; 与普通材料的反应性:无反应; 运输稳定性:稳定; 酸中和剂和苛性碱:不适合; 巧合:不适合; 聚合抑制剂: 不适合。 |
| 安全概况 | 通过腹膜中毒。 静脉内和皮下注射有中等毒性。 吸入后毒性很大。 一种实验性致畸剂。 吸入对人类的全身影响:中枢神经系统记录的变化、幻觉或扭曲的知觉、运动活动的变化、抗精神病药物的变化、精神药理学和骨髓变化。 实验生殖效应。 报告突变数据。 对人眼有刺激作用。 经皮肤测试,对眼睛有严重刺激。 甲苯源自煤焦油,商业级甲苯通常含有少量苯作为杂质。 超过 8 小时吸入 200 ppm 甲苯会导致协调性和反应时间受损; 在较高浓度(高达 800 ppm)时,这些影响会增加,并且在较短的时间内观察到。 在少数报告的急性甲苯中毒病例中, 麻醉药物的作用使工人进入中毒和昏迷状态。 脱离接触后恢复已成为惯例。 慢性中毒的罕见报告描述了贫血和白细胞减少症,活检显示骨髓发育不全。 然而,这些影响在使用甲苯的人中不太常见,而且也没有那么严重。 据报道,浓度达到 200-500 ppm 时,会出现头痛、恶心、眼睛刺激、食欲不振、味觉不愉快、疲劳、协调性和反应时间受损,但通常不会伴有任何明显的实验室或身体检查结果。 随着浓度的升高,上述症状会增加,此外,在极少数情况下可能会出现贫血、白细胞减少和肝肿大。 现代建筑材料排放的一种常见空气污染物 - (CENEAR 69, 22,91)。 用于制造滥用药物。 可燃液体。 当暴露于热、火焰或氧化剂时,火灾危险是非常危险的。 暴露于热或火焰时会爆炸为蒸气。 与1,3-二氯-5,5-二甲基-2,4-咪唑啉二酮、四氧化二氮、浓硝酸、H2SO4 + HNO3、N2O4、AgClO4、BrF3、UF6、二氯化硫发生爆炸反应。 与四硝基甲烷形成爆炸性混合物。 能与氧化性物质发生剧烈反应。 灭火时必须使用泡沫、二氧化碳、干粉。 受热分解,放出刺激性烟雾和刺激性烟雾。 四氧化二氮、浓硝酸、H2SO4 + HNO3、N2O4、AgClO4、BrF3、UF6、二氯化硫。 与四硝基甲烷形成爆炸性混合物。 能与氧化性物质发生剧烈反应。 灭火时必须使用泡沫、二氧化碳、干粉。 受热分解,放出刺激性烟雾和刺激性烟雾。 四氧化二氮、浓硝酸、H2SO4 + HNO3、N2O4、AgClO4、BrF3、UF6、二氯化硫。 与四硝基甲烷形成爆炸性混合物。 可能与氧化材料发生剧烈反应。 为了灭火,必须使用泡沫、二氧化碳和干粉。 加热分解时,放出辛辣刺激性烟雾。 |
| 联系的可能性 | 甲苯用作工业化学品和化学中间体; 溶剂和乳化剂; 苯的生产过程中可能会发生。 也用作甲苯二异氰酸酯、苯酚、苄基及苯甲酰衍生物的化工原料; 苯甲酸; 甲苯磺酸盐; 硝基甲苯、乙烯基甲苯和糖精; 作为油漆和涂料的溶剂; 或作为汽车和航空燃料的成分。 |
| 致癌特性 | IARC 已确定,没有证据表明甲苯对实验动物不会致癌,也没有足够的证据表明甲苯对人类具有致癌性。 体外试验结果普遍表明甲苯不具有遗传毒性。 关于暴露工人中姐妹染色单体交换和染色体断裂率增加的报告因同时暴露于其他有机化学品而令人困惑。 |
| 来源 | 在 87 辛烷汽油 (25.9 mg/L)、94 辛烷汽油 (86.9 mg/L)、汽油醇 (60.8 mg/L)、2 号燃油 (1.54 mg/L)、喷气燃料 A 的水溶性馏分中检出(1.05 mg/L)、柴油 (0.86 mg/L)、军用喷气燃料 (JP-4 (32.0 mg/L) (Potter, 1996)、新发动机油 (16.3 至 16.9 8 µg/L) 和二手发动机油 (781–814 µg/L) (Chen et al., 1994)。美国石油学会估计 PS-6 汽油中的平均质量百分比和摩尔分数分别为 3.519 和 0.04392 (Poulsen et al., 1992) ) Schauer 等人 (1999) 报道中型柴油卡车尾气中的甲苯排放率为 3,980 微克/公里。从瑞士 Schlieren 的一个加油站获得的柴油中含有甲苯,估计浓度为 374 毫克/升 (Schluep等人,2001)。 Thomas 和 Delfino (1991) 将从佛罗里达州盖恩斯维尔收集的无污染地下水与三种单独的石油产品的单独等分试样在 24–25 °C 下平衡 24 小时。 通过美国 EPA 批准的测试方法 602 分析水相中的有机化合物。据报道,无铅汽油、煤油和柴油的水溶性馏分中的平均甲苯浓度分别为 23.676、1.065 和 0.552 mg/L。 当作者通过美国 EPA 批准的测试方法 610 分析水相时,无铅汽油、煤油和柴油的水溶性馏分中的平均甲苯浓度分别较低,即 12.969、0.448 和 0.030 mg/L 。 卡普兰等人。 (1996) 测定了四种不同类型汽油中的甲苯浓度。 普通无铅汽油中的平均甲苯浓度为32.6克/升,无铅汽油中为28.7克/升,无铅+汽油中为36.7克/升,超级无铅汽油中为40.9克/升。 哈雷等人。 (2000)分析了三种无铅汽油的蒸气,其中添加乙醇代替甲基叔丁基醚。 上部间隙中的甲苯汽油蒸气浓度,普通级为1.9重量%,中级为1.8重量%,特级为2.0重量%。 在 7 个煤焦油样品中,甲苯浓度范围为 ND 至 7,000 ppm(EPRI,1990)。 在 1 年的煤焦油膜和散装煤焦油中检测到,浓度分别 高温煤焦油含有平均浓度为 0.25 wt% 的甲苯(McNeil,1983)。 被鉴定为从各种牛肉、鸡肉和小牛肉产品的油炸加工厂收集的废大豆油中的 140 种挥发性成分之一(Takeoka 等,1996)。 绍尔等人。 (2001) 测量了住宅区(壁炉)中常规燃烧、橡树和桉树的挥发性有机化合物、气相半挥发性有机化合物和颗粒相有机化合物的有机化合物排放率。 甲苯的气相排放率为158mg/kg燃烧的松木。 没有测量橡树和桉树燃烧过程中的甲苯排放率。 据报道,98.5 wt% 苄硫醇中存在杂质(≤ 0.8 wt%)(Chevron Phillips,2005 年 4 月)。 饮用水标准(最终):MCLG:1mg/L; MCL:1毫克/升。 此外,推荐的 DWEL 为 7 μg/L(US EPA, 2000)。 |
| 环境命运 | 生物学。甲苯会受到两种类型的微生物攻击。 第一种类型通过苯环的立即羟基化进行,然后进行环断裂。 第二种类型的攻击通过甲基的氧化进行,然后进行羟基化和环裂解(Fewson,1981)。 恶臭假单胞菌的突变体将甲苯氧化为 (+)-顺-2,3-二羟基-1-甲基环己-1,4-二烯(Dagley,1972)。 Claus 和 Waker (1964) 报道了假单胞菌属 sp。 和无色杆菌属。 将甲苯氧化成 3-甲基儿茶酚。 在甲苯的微生物降解中鉴定的其他代谢物包括顺式-2,3-二羟基-2,3-二氢甲苯、3-甲基儿茶酚、苯甲醇、苯甲醛、苯甲酸、儿茶酚(引文,Verschueren,1983)和 1-羟基- 2-萘甲酸(Claus 和 Walker,1964)。 在产甲烷含水层材料中, 甲苯完全分解为二氧化碳(Wilson 等,1986)。 在活性污泥中,5 天后 26.3% 的用过的甲苯矿化为二氧化碳(Freitag 等,1985)。 根据 0.07/年的一级衰减率常数,甲苯的半衰期为 39 天(Zoeteman 等,1981)。 光解作用。 考克斯等人。 (1980) 报告速率常数为 7.2 x 10 -12 cm 气态甲苯与OH自由基的反应的3 /分子·秒基于乙烯与OH自由基的反应的8×10 -12 cm 3 / 分子·秒的值。 表面有水。Mackay 和 Wolkoff (1973) 估计温度为 25°C、深度为 1 m 的地表水的蒸发半衰期为 30.6 分钟。地下水。尼尔森等人。(1996) 研究了丹麦日德兰半岛浅层、冰川、无承压砂质含水层中的甲苯分解。作为原位显微研究的一部分,通过距地面约 5 m 的套管钻孔安装了一个底部开口、顶部屏蔽的圆柱体。 五升水与大气混合,以确保维持有氧条件。 大约 3 个月内每周分析一次地下水,以确定一段时间内的甲苯浓度。 通过实验确定一级生物降解速率常数,5天滞后期后相应的半衰期分别为0.4/天和1.73天。 光解作用。含有气态亚硝酸和甲苯的合成空气暴露在人造阳光(λ = 300–450 nm)下会产生硝酸甲酯、过氧缩醛硝酸盐和硝基芳香族化合物,初步鉴定为硝基苯酚或硝基甲酚(Cox 等,1980)。 正己烷溶液含有甲苯,并在用汞中压灯照射的冷水(10°C)上展开为薄膜(4mm)。 3 小时内,26% 的甲苯被光催化生成苯甲醛、苯甲醇、苯甲酸和间甲酚(Moza 和 Feicht,1989)。 据报道,甲烷和乙烷是甲苯在 2537? 气相光解的产物。 (卡尔弗特和皮茨,1966)。 化学/物理。从甲苯与一氧化氮和 OH 自由基的反应中鉴定出的产物包括苯甲醛、苯甲醇、3-硝基甲苯、对甲基苯醌以及邻、间和对甲酚(Kenley 等,1978)。 气态甲苯在纯净空气中与硝酸根反应生成以下产物:苯甲醛、苯甲醇、硝酸苄酯和2-、3-和4-硝基甲苯(Chiodini 等,1993)。 在大气条件下,与 OH 自由基和氮氧化物的气相反应导致苯甲醛、硝酸苄酯、3-硝基甲苯以及邻、间和对甲酚的形成(Finlayson-Pitts 和 Pitts,1986;Atkinson, 1990)。 |
| 在有机物中的溶解度 | 溶于丙酮、二硫化碳和汽油; 与乙酸、乙醇、苯、乙醚、氯仿(US EPA, 1985)和其他有机溶剂(包括二甲苯、甲苯和乙苯)混溶。 |
| 仓库 | 甲苯只能在没有火源的区域使用,大于 1 升的甲苯应储存在密封的金属容器中,并与氧化剂分开。 |
| 船运 | UN1294 甲苯,危险等级:3; 标签:3-易燃液体。 |
| 纯化方法 | 用CaCl2、CaH2 或CaSO4 干燥甲苯,并通过与钠、P2O5 或CaH2 静置进一步干燥。 它可由钠或五氧化五部分蒸馏而成。 除非经过特殊纯化,否则甲苯可能会被甲基噻吩和其他含硫杂质污染。 这些物质可用浓H2SO4振摇除去,但若要避免甲苯磺化,温度必须保持在30℃以下。 典型的程序包括用冷 H2SO4(每升 100mL 酸)摇动甲苯两次,用水摇动一次,用 5% NaHCO3 或 NaOH 溶液摇动一次,再用 H2O 摇动,然后用 CaSO4 和 P2O5 连续干燥,最后从 P2O5 或 P2O5 中蒸馏。回流30分钟后更多LiAlH4。 或者,可以用 1% 钠汞齐回流煮沸代替 NaHCO3 处理。 硫化合物也可以通过长时间摇动甲苯和汞来去除,或者通过从 AlCl3 中进行两次蒸馏,然后将馏出物用水洗涤,用 K2CO3 干燥并储存在金属钠中。 其他纯化过程包括从二苯基苦基肼和 SnCl2 中回流和蒸馏干燥甲苯钠(以确保不存在过氧化物)。 它还与10%体积的乙基甲基酮共蒸馏并再次蒸馏。 [Brown & Pearsall J Am Chem Soc 74 191 1952.] 对于羰基杂质,请参见*苯。 在二苯甲酮羰基钠存在下,通过在氮气下蒸馏纯化甲苯。 甲苯也用 MgSO4 干燥,除去硫杂质后,然后从 P2O5 中部分蒸馏并储存在黑暗中 [Tabushi et al. 美国化学学会杂志 107 4465 1985]。 甲苯可以通过压实的富勒土柱进行纯化。 Tinh chế nhanh: Làm khô toluene bằng rây phân tử alumina, CaH2 và 4A (3% w/v) (khuấy và để yên trong 6 giờ). Sau đó, toluene được chưng cất và 5% sản phẩm chưng cất đầu tiên được loại bỏ và lưu trữ trên các sàng phân tử (3A, 4A) hoặc dây Na. [Beilstein 5 H 280, 5 I 144, 5 II 209, 5 III 651, 5 IV 766. ] |
| Đánh giá độc tính | Cơ chế gây độc của nó bị nghi ngờ là tương tự như các dung môi khác, có thể nhanh chóng gây ra tác dụng giống như gây mê, tức là "gây mê không đặc hiệu" do sự phá vỡ (hòa tan) tính toàn vẹn màng tế bào của hệ thần kinh trung ương (CNS). . Hiệu ứng này tương tự như cảm giác "phê" khi tiếp xúc với các dung môi hydrocarbon khác. Như đã được quan sát thấy khi tiếp xúc với các dung môi hydrocarbon khác, toluene có độc tính vừa phải khi hít phải, gây kích ứng đường hô hấp và gây mê. Toluene dường như có tác dụng đảo ngược đối với gan, thận và hệ thần kinh. Hệ thống thần kinh dường như nhạy cảm nhất với tác dụng của toluene. Tiếp xúc với lượng lớn toluene có thể gây mất khả năng phối hợp, mất điều hòa, lú lẫn và cuối cùng là tử vong. Việc tiếp xúc cấp tính ở người với nồng độ thấp hơn của chất này có thể gây chóng mặt, hưng phấn và lú lẫn. Mặc dù cơ chế sinh hóa thực tế của độc tính vẫn chưa rõ ràng, nhưng tác dụng gây mê quan sát được có thể liên quan đến đặc tính dung môi vật lý của nó. |
| Không tương thích | Không tương thích với các tác nhân oxy hóa (clorat, nitrat, peroxit, kali permanganat, perchlorat, clo, brom, flo, v.v.); tiếp xúc có thể gây cháy hoặc nổ. Tránh xa các chất kiềm, bazơ mạnh, axit mạnh, axit chứa oxy và epoxit. Phản ứng dữ dội với hỗn hợp axit nitric và axit sulfuric. |
| xử lý chất thải | Vui lòng tham khảo cơ quan quản lý môi trường của bạn để được hướng dẫn về các biện pháp khắc phục có thể chấp nhận được. Những người tạo ra chất thải (>100 kg/tháng) có chứa chất gây ô nhiễm này phải tuân thủ các quy định của EPA về quản lý việc lưu trữ, vận chuyển, xử lý và tiêu hủy chất thải. |
Danh mục sản phẩm
铝棒挤压分离剂脱模剂 挤压隔离剂
2,2,2-Trifluoroetylamine hydrochloride
Benzophenon
1-Hydroxy-cyclohexyl-phenylmetanon
Axit benzoic
Axit fumaric
Phthalic anhydrit (phthalic anhydrit)
axit acrylic
Paraformaldehyde
Paraben isobutyl este 4247-2-3
Isopropyl paraben 4191-73-5
2,3Difluoro-5-chloropyridin 89402-43-7
paraben
propylparaben
Metyl anthranilat
o-Toluonitrile
p-Toluonitril
p-phenylbenzonitril
p-phenylbenzonitril
p-tert-butylbenzonitrile
m-metylbenzonitril
N,N-dimethylacrylamide 2680-03-7
Hạt nở
Hạt nhựa chức năng nhẹ PP&nhựa kỹ thuật
N,N'-(4,4'-Methylenediphenyl)bismaleimide 13676-54-5
Axit nonanoic 2-Ethyl-2-(hydroxymetyl)propan-1,3-diol
Xanthat
Xanthat
7-Hydroxybenzofuran (furanol) 4790-81-2
2,2-oxydietanol
Didecyl phtalat 84-77-5
Dinonyl phthalate 84-76-4
Metacrylat 922-67-8
Axit trichloroisocyanuric 87-90-1
Trichloropolyamine Urate
N-undecane
4,4'-Bismaleimide diphenylmethane 13676-54-5
Isooctyl acrylat 103-11-7
Trihydroxymetylpropan
1-cyanoguanidine (dicyandiamide)
Natri cyclamate (cyclamate) 139-05-9
Phthalic anhydrit 85-44-9
Vinyl axetat 108-05-4
Diethylene glycol 111-46-6
Acetaminophen 103-90-2
Axit isophthalic 121-91-5
脱模剂
Methacrylat 922-67-8
Axit terephthalic (TPA) 100-21-0
Butyl acrylat 141-32-2
Metacrylat 79-41-4
Metyl methacrylat 80-62-6
Hydroxyetyl methacrylat 868-77-9
Dimetyl adipat 627-93-0
Dimetyl succinat 106-65-0
Este dibasic dbe 95481-62-2
Dimetyl glutarate 1119-40-0
1,5-pentanediol 111-29-5
N-dodecane 112-40-3
Allyl glycidyl ete 106-92-3
PMDA pyromellitic dianhydrit 89-32-7
Propylene glycol metyl ete axetat PMA
Propylene Glycol Metyl Ether PM
N-heptan 142-82-5
Tetrametylamoni hydroxit 25% 2,38% 75-59-2
Metyl axetat 79-20-9
Tetrachloroethylene 127-18-4
Tricloetylen 79-01-6
Xylen 1330-20-7
Cyclohexanone
Etanol tuyệt đối 64-17-5
Butyl axetat 123-86-4
Axeton 67-64-1
Butanon 78-93-3
Toluen 108-88-3
N-propyl bromua npb
Fluorodichloroethane (HCFC-141b)
Chất xử lý PP
DMP-30Sửa đổi
Nhựa polyamit 63428-84-2
Isobornyl methacrylat IBOMA 7534-94-3
Dipentaerythritol hexaacrylat DPHA 29570-58-9
Dầu tẩy vết bẩn Dầu tẩy vết bẩn Dầu tẩy vết bẩn
Nước rửa phim, nước rửa phim, nước rửa phim, dung dịch PCB
Trimethylolpropane trimethacrylate TMPTMA 3290-92-4
Trimethylolpropane Triacrylate TMPTA
Chất pha loãng mực thẻ cào
Pentaerythritol triacrylat 3524-68-3
Methaclean
Chất đóng rắn nhựa Epoxy 593
Máy làm sạch phim
Dầu dung môi Isoparaffin D60
Băng khác nhau 98-82-8
Tripropylene glycol diacrylat TPGDA 42978-66-5
Dipropylene glycol diacrylate DPGDA
Carbon dodecyl thành myristyl glycidyl ete 68609-97-2
Chất tẩy rửa có độ tinh khiết cao HCFC-141B chính hãng Sanaifu có độ tinh khiết cao
1,6-Hexanediol diglycidyl ete 16096-31-4
1,4-Butanediol diglycidyl ete 2425-79-8
Chất tẩy rửa chống cháy (chất tẩy rửa không cháy)
Chất pha loãng phản ứng Epoxy 692
Neopentyl glycol diglycidyl ete 17557-23-2
Trimethylolpropan triglycidyl ete 30499-70-8
Butyl glycidyl ete
Polypropylen glycol diglycidyl ete 26142-30-3
Polyetylen glycol diglycidyl ete 39443-66-8
除漆剂
Rượu công nghiệp
Một dung môi mới --- chất thay thế cho metyl etyl xeton
Butyl glycidyl ete (BGE) 2426-08-6
Hydrofluoroether 347 - 406-78-0
Este axit etylic [4]
Phenyl glycidyl ete 122-60-1
Dipropylene glycol diacrylate DPGDA
Rượu isopropyl 67-63-0
Chất tẩy mực TA-55B
Chất làm sạch thông lượng
Dòng TF-9000 dùng một lần không chì
Dòng TF-800T dùng một lần truyền thống
Chất tẩy rửa thân thiện với môi trường TF-2000-3
Chất tẩy rửa GB38508-2020
Dầu thủy lực chống mài mòn cao áp HM46
Chất tẩy rửa không chì TF-B5
Chất làm sạch môi trường không chứa halogen
Chất tẩy rửa bo mạch
Dầu EDM tổng hợp tốc độ cao EDM-2
Chất tẩy vết dầu dập
Chất làm sạch điểm không chớp cháy thân thiện với môi trường
Chất làm sạch siêu âm hydrocarbon
Nước giặt lưới 718 là
Chất tẩy rửa ENEOS Chất tẩy rửa hydrocarbon NSclean 100 Nhật Bản
Chất tẩy rửa hydrocarbon có điểm chớp cháy cao (an toàn và không bắt lửa) XHC-280 tuân thủ VOC
Chất làm sạch hydrocarbon
Nước giặt không chì
Chất tẩy rửa nhôm
O-metylisourea sunfat
2,2,2-Trifloetylamin
Guanidine Nitrat
1,1-axit thân thiện với môi trường 99189-60-3
1,1-Axit dioxylic 4335-11-7
6,8-Dichlorooctanoat 1070-64-0
Methylparaben
Axit parahydroxybenzoic 99-96-7
Parahydroxybenzonitrile 767-00-0
Triisobutyl photphat
canxi dihydroxybenzen sulfonate
Kali dihydroxybenzensulfonat
Axit dichlorobenzoic
axit p-chlorobenzoic
axit o-chlorobenzoic
axit p-nitrobenzoic
1,2-Dicloropropan
Axit p-Hydroxybenzensulfonic (65%)
1,1,2-Tricloan
Melamine polyphosphate (FR—NP)
Melamine Phosphate (FR-MP)
Melamine xyanurat (MC)
Tribromophenoxytetrabromobisphenol
phenoxytetrabromobisphenol
Melamine polyphosphate (FR—NP)
Melamine Phosphate (FR-MP)
Melamine xyanurat (MC)
Tribromophenoxytetrabromobisphenol
phenoxytetrabromobisphenol
Rượu tribromoneopentyl
dibromoneopentyl glycol
1,4-dicyano-2-buten
Methylene metan disulfonat (MMDS)
Propylen sunfat (TS)1073-05-8
Pentylenediamine còn được gọi là 1,5-diaminopentane
Axit undecanoic (DC18)
Axit undecanoic (DC16)
Axit undecanoic (DC14)
Axit undecanoic (DC13)
Axit undecanoic (DC12)
Axit undecanoic (DC11)
Axit fluosilicic
Axit floboric
Axit Fluotitonic
Axit Fluozirconic
Amoni fluoziconat
Amoni florua
Kali hydro florua
kali fluoroaluminate
Kali Fluozirconat
Kali Fluotitanat
Kali Fluoborat
Cloramin T (muối natri p-toluenesulfonyl chloramine) 127-65-1
Natri p-toluenesulfonate 12068-03-0
p-Toluenesulfonate 80-40-0
Metyl o-p-toluenesulfonat 28804-47-9
Acryloylmorpholin 5117-12-4
4,4'-Dichlorodiphenylsulfone 80-07-9
4,4-Dihydroxydiphenylsulfone (bisphenol S) 80-09-1
Diphenyl sulfone 127-63-9
Benzenesulfonyl clorua 98-09-9
Benzenesulfonamit 98-10-2
N-Toluenesulfonamide 80-39-7
o-p-Toluenesulfonamide 98-10-2
o-Toluenesulfonamide 88-19-7
p-Toluenesulfonamide 70-55-3
N-Butylbenzensulfonamit 3622-84-2
N-O-p-Toluenesulfonamide 8047-99-2
p-Toluenesulfonyl clorua 98-59-9
chất xử lý bề mặt kính
phụ gia đánh bóng hóa học
Chất chống dấu vân tay
Chất chống dấu vân tay
Chất mạ
chất tẩy nhờn
chất keo tụ ST
Chất ức chế cặn ống màng RO
Chất đình chỉ B
Chất làm sạch
Chất khử cặn nồi hơi
Thuốc diệt tảo oxy hóa
Thuốc diệt nấm không oxy hóa
Chất ức chế ăn mòn và cặn
Tẩy sơn đa năng
Chất tẩy rửa linh kiện điện tử
Dung dịch tẩy rửa bề mặt mạch điện
Chất lỏng cắt
Dầu chống gỉ hòa tan trong nước
Dầu chống gỉ
dung dịch tẩy rửa ngoại thất ô tô
Chất làm sạch ổ trục chính xác
Máy thoát y điện móc
nước bảo vệ bạc
Chất bảo vệ chống xỉn màu đồng
Chất khử nước
Chất khử keo
Trình kích hoạt
bộ điều chỉnh độ nhám
chất khử trung hòa
chất lỏng làm nhám
Chất tẩy dầu mỡ và ưa nước
Tẩy dầu mỡ/tiền sưng tấy
Chất tăng trắng mạ crom hóa trị ba
Chất chống sương mù Chrome
Chất tăng trắng mạ bạc
Chất chống xỉn màu mạ vàng
Muối dẫn điện mạ vàng trung tính
Muối dẫn điện mạ vàng axit
Phụ gia mạ thiếc mờ hoàn toàn sunfat
Phụ gia mạ thiếc axit sunfuric hoàn toàn sáng
bột đồng tẩm
Chất tăng trắng pyrophosphate đồng
Chất mạ đồng sáng axit
Chất tăng trắng đồng mạ điện
Chất tăng trắng đồng được điện hóa
chất thụ động màu crom hóa trị ba
Chất thụ động hóa trị ba crom trắng xanh hóa trị ba
Chất mạ kẽm sáng axit
Chất làm ướt ít bọt mạ niken
Chất di chuyển mạ niken
Phụ trợ mạ niken
Chất làm mềm mạ niken
Loại bỏ sắt khỏi nước
nước tẩy đồng
Nước tẩy kẽm
Chất tăng trắng mạ niken
Chất tăng trắng mạ niken thùng
Chất tăng trắng niken điện hóa
Chất làm bóng niken điện hóa
Chất tẩy rửa hợp kim nhôm
Muối axit hoạt tính
Đánh bóng hóa học đồng và hợp kim đồng
Chất tẩy rửa chuyên dụng cho bản mạch
Chất tẩy rửa đặc biệt
Chất tẩy nhờn có tính kiềm yếu
Chất tẩy rửa tính axit thấp
Chất tẩy rửa có tính axit hiệu quả cao
Bột điện phân tẩy dầu cho hợp kim nhôm kẽm
Bột điện phân tẩy dầu cho hợp kim đồng
Bột điện phân tẩy dầu mỡ cho sắt
Bột hóa học tẩy dầu mỡ cho hợp kim nhôm kẽm
Bột hóa học tẩy dầu cho hợp kim đồng
Bột hóa học tẩy dầu cho sắt thép
Nước tẩy sáp cho hợp kim nhôm kẽm
Nước tẩy sáp cho hợp kim đồng
Nước tẩy sáp cho linh kiện sắt thép
Copyright © 2021. All rights reserved Thiết kế web iHappy.








